Obsah
Ostatné oddielyAtóm elektrónová konfigurácia je číselné vyjadrenie jeho elektrónových orbitálov. Elektrónové orbitály sú rôzne tvarované oblasti okolo jadra atómu, kde je matematicky pravdepodobné, že sa budú nachádzať elektróny. Elektrónová konfigurácia môže čitateľovi rýchlo a jednoducho povedať, koľko elektrónových orbitálov má atóm, ako aj počet elektrónov osídľujúcich každý jeho orbitál. Keď pochopíte základné princípy konfigurácie elektrónov, budete môcť napísať svoje vlastné konfigurácie a spoľahlivo zvládnuť tieto chemické testy.
Kroky
Metóda 1 zo 4: Kontrola
- Čo je to elektrónová konfigurácia? Elektrónová konfigurácia ukazuje distribúciu elektrónov atómu alebo molekuly. Existuje konkrétny zápis, ktorý vám môže rýchlo ukázať, kde sa elektróny pravdepodobne nachádzajú, takže znalosť tohto zápisu je nevyhnutnou súčasťou poznania konfigurácií elektrónov. Čítanie týchto notácií vám môže povedať, o ktorom prvku hovoríte a koľko elektrónov má.
- Štruktúra periodickej tabuľky je založená na konfigurácii elektrónov.
- Napríklad zápis pre fosfor (P) je.
- Čo sú to elektrónové obaly? Oblasť, ktorá obklopuje jadro atómu, alebo oblasť, kde obiehajú elektróny, sa nazýva elektrónový obal. Zvyčajne existujú asi 3 elektrónové škrupiny na atóm a usporiadanie týchto škrupín sa nazýva elektrónová konfigurácia. Všetky elektróny v rovnakom obale musia mať rovnakú energiu.
- Elektrónové škrupiny sa tiež niekedy označujú ako energetické hladiny.
- Čo je to atómový orbitál? Keď atóm získava elektróny, vypĺňajú rôzne orbitálne súbory podľa konkrétneho poradia. Každá sada orbitálov, ak je plná, obsahuje párny počet elektrónov. Orbitálne súpravy sú:
- Orbitálna súprava (ľubovoľné číslo v elektrónovej konfigurácii, za ktorým nasleduje písmeno „s“) obsahuje jeden orbitál a znak Pauliho princíp vylúčenia, jeden orbitál môže obsahovať najviac 2 elektróny, takže každá orbitálna súprava môže obsahovať 2 elektróny.
- Orbitálna súprava obsahuje 3 orbitaly, a teda môže obsahovať celkom 6 elektrónov.
- D orbitálna súprava obsahuje 5 orbitálov, takže pojme 10 elektrónov.
- Orbitálna súprava obsahuje 7 orbitálov, takže pojme 14 elektrónov.
- Orbitálne množiny g, h, i a k sú teoretické. Žiadny známy atóm nemá na žiadnom z týchto orbitálov elektróny. Súprava g má 9 orbitálov, takže by teoreticky mohla obsahovať 18 elektrónov. Súprava h by mala 11 orbitálov a maximálne 22 elektrónov, súprava i mala 13 orbitalov a maximálne 26 elektrónov a súprava k mala 15 orbitalov a maximálne 30 elektrónov.
- Pamätajte si poradie písmen pomocou tejto mnemotechniky:Sober Physicisti Dnie Find Giraffes Hiding Jan Ksvrbenie.
- Čo sú prekrývajúce sa orbitaly? Niekedy elektróny zaberajú spoločný orbitálny priestor. Vezmime si molekulu dihydrogénu alebo H2. 2 elektróny musia zostať blízko seba, aby zostali navzájom priťahované a navzájom sa spájali. Pretože sú si tak blízki, budú zaberať rovnaký orbitálny priestor, a teda zdieľať orbitál alebo ho prekrývať.
- Vo svojom zápise by ste jednoducho zmenili číslo riadku na 1 menej, ako je v skutočnosti. Napríklad elektrónová konfigurácia pre germánium (Ge) je Aj napriek tomu, že pôjdete až k štvrtému riadku, v strede je kvôli prekrytiu stále „3d“.
- Ako používate tabuľku konfigurácie elektrónov? Ak máte problém s vizualizáciou svojho zápisu, môže byť užitočné použiť konfiguračnú tabuľku elektrónov, aby ste skutočne videli, čo píšete. Zostavte základnú tabuľku tak, aby úrovne energie smerovali dole k osi y a orbitálny typ prechádzal cez os x. Odtiaľ môžete kresliť svoju notáciu v zodpovedajúcich medzerách tak, že idú smerom nadol k osi y a cez os x. Potom môžete podľa riadku získať svoju notáciu.
- Napríklad, ak by ste písali konfiguráciu pre berýlium, začali by ste od 1. sekundy a potom by ste sa vrátili späť k 2. sekvenciám. Pretože berýlium má iba 4 elektróny, po tom by ste sa zastavili a pochopili ste to
Metóda 2 zo 4: Priradenie elektrónov pomocou periodickej tabuľky
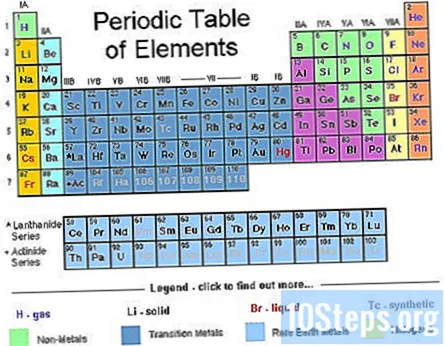
Nájdite atómové číslo svojho atómu. Každý atóm má s ním spojený konkrétny počet elektrónov. Nájdite chemický symbol svojho atómu v periodickej tabuľke. Atómové číslo je kladné celé číslo začínajúce na 1 (pre vodík) a zvyšujúce sa o 1 pre každý nasledujúci atóm. Atómové číslo atómu je počet protónov atómu - je to teda aj počet elektrónov v atóme s 0 nábojom.- Pretože periodická tabuľka je založená na konfigurácii elektrónov, môžete ju použiť na určenie zápisu konfigurácie prvku.
- Určte náboj atómu. Nenabité atómy budú mať presne taký počet elektrónov, aký je uvedený v periodickej tabuľke. Avšak nabité atómy (ióny) budú mať vyšší alebo nižší počet elektrónov na základe veľkosti ich náboja. Ak pracujete s nabitým atómom, sčítajte alebo odčítajte elektróny príslušným spôsobom: pridajte 1 elektrón pre každý záporný náboj a odčítajte 1 pre každý kladný náboj.
- Napríklad atóm sodíka s nábojom +1 by mal elektrón odobratý zo základného atómového čísla 11. Takže atóm sodíka by mal celkovo 10 elektrónov.
- Atóm sodíka s nábojom -1 by mal k základnému atómovému číslu 11 pridaný 1 elektrón. Atóm sodíka by potom mal celkovo 12 elektrónov.
- Pochopte zápis konfigurácie elektrónov. Elektrónové konfigurácie sú napísané tak, aby zreteľne zobrazovali počet elektrónov v atóme, ako aj počet elektrónov v každej obežnej dráhe. Každá obežná dráha je napísaná postupne, pričom počet elektrónov v každej obežnej dráhe je napísaný horným indexom napravo od jeho názvu. Konečná konfigurácia elektrónov je jediný reťazec orbitálnych mien a horných indexov.
- Napríklad tu je jednoduchá konfigurácia elektrónov: 1 s 2 s 2 str. Táto konfigurácia ukazuje, že v orbitálnej sade 1 s sú 2 elektróny, v orbitálnej sade 2 s a 6 elektrónov v orbitálnej sade 2p. 2 + 2 + 6 = spolu 10 elektrónov. Táto elektrónová konfigurácia je pre nenabitý atóm neónu (atómové číslo neónu je 10.)
- Zapamätajte si poradie orbitálov. Všimnite si, že orbitálne sústavy sú očíslované elektrónovým plášťom, ale sú usporiadané podľa energie. Napríklad naplnená 4s je nižšia energia (alebo menej potenciálne prchavá) ako čiastočne naplnená alebo naplnená 3d, takže škrupina 4s je uvedená ako prvá. Keď poznáte poradie orbitálov, môžete ich jednoducho vyplniť podľa počtu elektrónov v atóme. Poradie na vyplnenie orbitalov je takéto: 1 s, 2 s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Bude napísaná elektrónová konfigurácia pre atóm s úplne vyplneným každým orbitom: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Všimnite si, že vyššie uvedený zoznam, ak by boli všetky škrupiny naplnené, by bola elektrónová konfigurácia pre Og (Oganesson), 118, atóm s najvyšším počtom v periodickej tabuľke - takže táto elektrónová konfigurácia obsahuje každý v súčasnosti známy elektrónový obal pre neutrálne nabitý atóm.
- Vyplňte orbitaly podľa počtu elektrónov vo vašom atóme. Napríklad, ak chceme napísať elektrónovú konfiguráciu pre nenabitý atóm vápnika, začneme nájdením jeho atómového čísla v periodickej tabuľke. Jeho atómové číslo je 20, preto napíšeme konfiguráciu pre atóm s 20 elektrónmi podľa vyššie uvedeného poradia.
- Naplňujte orbitaly podľa vyššie uvedeného poradia, kým nedosiahnete celkom 20 elektrónov. 1s orbitál dostane 2 elektróny, 2s dostane 2, 2p dostane 6, 3s dostane 2, 3p dostane 6 a 4s dostane 2 (2 + 2 + 6 +2 +6 + 2 = 20). elektrónová konfigurácia pre vápnik je: 1s 2s 2p 3s 3p 4s.
- Poznámka: Úroveň energie sa mení, ako stúpate. Napríklad, keď sa chystáte ísť na 4. energetickú úroveň, stane sa najskôr 4 s, potom 3d. Po štvrtej energetickej úrovni sa presuniete na 5., kde bude nasledovať poradie ešte raz (5 s, potom 4 d). To sa deje až po 3. energetickej úrovni.
- Periodickú tabuľku použite ako vizuálnu skratku. Možno ste si už všimli, že tvar periodickej tabuľky zodpovedá rádu orbitálnych sád v elektrónových konfiguráciách. Napríklad atómy v druhom stĺpci zľava vždy končia na „s“, atómy úplne vpravo od chudej strednej časti končia vždy na „d“ atď. Periodickú tabuľku používajte ako vizuálnu príručku na písanie konfigurácií - príkaz, aby ste pridali elektróny na orbitaly, zodpovedá vašej pozícii v tabuľke.
- Konkrétne 2 stĺpce úplne vľavo predstavujú atómy, ktorých elektrónové konfigurácie sa končia s orbitálmi, pravý blok tabuľky predstavuje atómy, ktorých konfigurácie sa končia p orbitálmi, stredná časť, atómy končiace d orbitálom a spodná časť atómy končiace na f orbitáloch.
- Napríklad pri písaní elektrónovej konfigurácie pre chlór si myslite: „Tento atóm je v treťom riadku (alebo„ perióde “) periodickej tabuľky. Nachádza sa tiež v piatom stĺpci orbitálneho bloku periodickej tabuľky. Jeho elektrónová konfigurácia skončí ... 3s
- Pozor: orbitálne oblasti d a f tabuľky zodpovedajú energetickým úrovniam, ktoré sa líšia od obdobia, v ktorom sa nachádzajú. Napríklad prvý riadok orbitálneho bloku d zodpovedá 3d obežnej dráhe, aj keď je v období 4, zatiaľ čo prvý rad f orbitálu zodpovedá orbitálu 4f, aj keď je v období 6.
- Naučte sa skratku pre písanie konfigurácií dlhých elektrónov. Atómy pozdĺž pravého okraja periodickej tabuľky sa nazývajú vzácne plyny. Tieto prvky sú chemicky veľmi stabilné. Ak chcete skrátiť proces zápisu dlhej elektrónovej konfigurácie, jednoducho napíšte chemický symbol najbližšieho chemického plynu s menším počtom elektrónov ako je váš atóm do zátvoriek a potom pokračujte v konfigurácii elektrónov pre nasledujúce orbitálne množiny.
- Pre pochopenie tohto konceptu je užitočné napísať príklad konfigurácie. Napíšeme konfiguráciu pre zinok (atómové číslo 30) pomocou skratky vzácneho plynu. Plná elektrónová konfigurácia zinku je: 1s 2s 2p 3s 3p 4s 3d. Všimnite si však, že 1s 2s 2p 3s 3p je konfigurácia pre Argon, vzácny plyn. Stačí nahradiť túto časť zónovej elektrónovej notácie Argonovým chemickým symbolom v zátvorkách (.)
- Takže konfigurácia elektrónov zinku napísaná v skratke je 4 s 3d.
- Upozorňujeme, že ak robíte notáciu vzácnym plynom napríklad pre argón, nemôžete písať! Musíte použiť vzácny plyn, ktorý prichádza pred týmto prvkom; pre argón by to bol neón ().
Metóda 3 zo 4: Použitie periodickej tabuľky ADOMAH

Pochopte periodickú tabuľku ADOMAH. Tento spôsob zápisu konfigurácií elektrónov nevyžaduje memorovanie. Vyžaduje si to však preskupenú periodickú tabuľku, pretože v tradičnej periodickej tabuľke, počnúc 4. riadkom, čísla period nezodpovedajú elektrónovým škrupinám. Nájdite periodickú tabuľku ADOMAH, špeciálny typ periodickej tabuľky, ktorý navrhol vedec Valery Tsimmerman. Ľahko sa dá nájsť pomocou rýchleho online vyhľadávania.- V periodickej tabuľke ADOMAH vodorovné riadky predstavujú skupiny prvkov, ako sú halogény, inertné plyny, alkalické kovy, kovy alkalických zemín atď. Zvislé stĺpce zodpovedajú elektrónovým plášťom a takzvaným „kaskádam“ (diagonálne čiary spájajúce s, p, d a f bloky) zodpovedajú obdobiam.
- Hélium sa pohybuje vedľa vodíka, pretože oba sú charakterizované obežnou dráhou 1 s. Bloky bodiek (s, p, d a f) sú zobrazené na pravej strane a čísla mušlí sú zobrazené na základni. Prvky sú prezentované v obdĺžnikových rámčekoch, ktoré sú očíslované od 1 do 120. Tieto čísla sú normálne atómové čísla, ktoré predstavujú celkový počet elektrónov v neutrálnom atóme.
- Nájdite svoj atóm v tabuľke ADOMAH. Ak chcete napísať elektrónovú konfiguráciu prvku, vyhľadajte jeho symbol v periodickej tabuľke ADOMAH a prečiarknite všetky prvky, ktoré majú vyššie atómové čísla. Napríklad, ak potrebujete napísať elektrónovú konfiguráciu Erbia (68), prečiarknite prvky 69 až 120.
- Všimnite si čísla 1 až 8 v spodnej časti tabuľky. Sú to čísla elektrónových škrupín alebo čísla stĺpcov. Ignorujte stĺpce, ktoré obsahujú iba prečiarknuté prvky. Pokiaľ ide o Erbium, zostávajúce stĺpce sú 1,2,3,4,5 a 6.
- Počítajte orbitálne súpravy až po váš atóm. Pri pohľade na symboly blokov zobrazené na pravej strane tabuľky (s, p, d a f) a na čísla stĺpcov zobrazené na základni a ignorovanie diagonálnych čiar medzi blokmi rozdeľte stĺpce na bloky stĺpcov a uveďte ich zoznam. v poradí zdola nahor. Opäť ignorujte bloky stĺpcov, kde sú prečiarknuté všetky prvky. Zapíšte bloky stĺpcov začínajúce číslom stĺpca nasledovaným symbolom bloku, napríklad takto: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (v prípade Erbia).
- Poznámka: Vyššie uvedená elektrónová konfigurácia Er je zapísaná v poradí stúpajúcich čísel škrupiny. Dalo by sa to napísať aj v poradí podľa orbitálnej výplne. Pri zapisovaní blokov stĺpcov postupujte podľa kaskád zhora nadol namiesto stĺpcov: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Spočítajte elektróny pre každú orbitálnu sústavu. Počítajte prvky, ktoré neboli preškrtnuté v každom blokovom stĺpci, pričom každému prvku je priradený 1 elektrón, a zapíšte ich množstvo vedľa symbolov bloku pre každý blokový stĺpec, napríklad takto: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. V našom príklade je to elektrónová konfigurácia Erbia.
- Poznajte nepravidelné konfigurácie elektrónov. Existuje osemnásť bežných výnimiek z konfigurácií elektrónov pre atómy v stave najnižšej energie, ktoré sa tiež nazývajú základný stav. Odchyľujú sa od všeobecného pravidla iba o posledné 2 až 3 polohy elektrónov. V týchto prípadoch skutočná elektrónová konfigurácia udržuje elektróny v stave s nízkou energiou ako v štandardnej konfigurácii pre atóm. Nepravidelné atómy sú:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Pozn (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) a Cm (..., 5f7, 6d1, 7s2).
Metóda 4 zo 4: Špeciálne prípady a výnimky
- Označenie katiónov: Pokiaľ ide o katióny, je to veľmi podobné neutrálnym atómom v uzemnenom stave. Začnite odstránením elektrónov v najvzdialenejšom orbitále, potom s a potom d.
- Napríklad základná elektronická konfigurácia vápnika (Z = 20) je. Vápnikový ión má však o 2 elektróny menej, takže by ste ich najskôr odstránili z najvzdialenejšieho obalu (čo sú 4). Konfigurácia pre vápnikový ión je teda.
- Označujúce anióny: Keď zaznamenáte anión, musíte použiť Aufbauov princíp, ktorý hovorí, že elektróny najskôr naplnia najnižšiu dostupnú hladinu energie, až potom sa presunú na vyššiu. Takže by ste pridali elektróny k najvzdialenejšej energetickej úrovni (alebo k najnižšej), skôr ako sa pohnete dovnútra, aby ste pridali ďalšie.
- Napríklad neutrálny chlór (Z = 17) má 17 elektrónov a je označený ako. Chloridový ión má však 18 elektrónov, ktoré by ste pridali od najvzdialenejšej energetickej úrovne. Preto je chloridový ión označený ako.
- Chróm a meď: Ako každé pravidlo, aj tu existujú výnimky. Aj keď väčšina prvkov dodržiava Aufbauov princíp, tieto prvky nie. Namiesto toho, aby prešli do stavu s najnižšou energiou, sú tieto elektróny pridané na úroveň, ktorá z nich urobí najstabilnejšie. Môže byť užitočné zapamätať si zápis pre tieto 2 prvky, pretože sa vzpierajú pravidlu.
- Cr =
- Cu =
Otázky a odpovede pre komunitu
V niektorých prvkoch som videl okrem elektronickej konfigurácie aj to, čo je napísané, atď. Čo to má byť?
Túto odpoveď napísal jeden z našich školených tímov výskumníkov, ktorí ju overili z hľadiska presnosti a komplexnosti.
Je to skratková notácia pre vzácny plyn, ktorý prichádza pred živel. V zásade je to spôsob, ako preskočiť krok, keď píšete svoju notáciu, aby ste na ňu nemuseli tráviť toľko času.
Čo je to elektrónová konfigurácia?
Elektrónová konfigurácia je usporiadanie elektrónu atómu alebo molekuly v atómovom alebo molekulárnom orbitáli.
Aká je elektrónová konfigurácia CH4?
CH4 nie je atóm, ale zložená látka. Poznáte iba elektrónovú konfiguráciu atómu.
Mali by počas písania EC prísť 4s skôr ako 3d?
Pri písaní EC berieme do úvahy energetické hladiny škrupín. 3d má vyššiu energetickú hladinu ako 4 s, preto príde po 4 s. Musíte si zapamätať poradie orbitálov podľa energetických úrovní.
Čo je to ionizačná energia?
Ionizačná energia je množstvo energie, ktoré musí izolovaný plynný atóm v základnom elektronickom stave absorbovať, aby mohol elektrón vybiť, výsledkom čoho je katión.
Ako je konfigurácia elektrónov a poradie pridávania elektrónov rovnaké pre každý prvok?
Pretože v každej škrupine, bez ohľadu na to, aký atóm, všetky obsahujú rovnaký počet elektrónov.
Ako vložím prvky do elektronickej konfigurácie pomocou čísel?
V zásade vezmete tradičnú škatuľkovú konfiguráciu a napíšete ju do čísel, kde prvé číslo predstavuje energetickú hladinu (tj. 1s ^ 2 je prvá energetická úroveň) a horný index predstavuje počet elektrónov v tejto energetickej úrovni (v predchádzajúcom príklade „ ^ 2 "znamená, že v tejto energetickej úrovni sú 2 elektróny).
Prečo sa železo volá Fe?
Latinský názov železa je ferrum.
Aké je číselné vyjadrenie elektronickej konfiguračnej zložky vápnika?
1s ^ 2 2s ^ 2 2p ^ 6 3s ^ 2 3p ^ 6 4s ^ 2. V zásade vezmete tradičnú škatuľkovú konfiguráciu a napíšete ju v skratke, kde prvé číslo predstavuje energetickú hladinu a horný index predstavuje počet elektrónov v tejto energetickej úrovni (rámček).
Ako napíšem elektronickú konfiguráciu uhlíka?
Atómové číslo uhlíka je 6. Preto má konfiguráciu 2s2 2p2. Rozbalená forma je 1s ^ 2 2s ^ 2 2p ^ 2.
Tipy
- Môžete tiež napísať elektrónovú konfiguráciu prvku iba napísaním valenčnej konfigurácie, čo je posledná orbitálna množina s a p.Valenčná konfigurácia atómu antimónu by teda bola 5s 5p.
- Existuje tiež veľa kalkulačiek na konfiguráciu elektrónov, ktoré môžete online použiť zadaním názvu prvku zadarmo. Spravidla však svoju prácu neukážu.
Každý deň sa na wikiHow tvrdo snažíme, aby sme vám poskytli prístup k pokynom a informáciám, ktoré vám pomôžu žiť lepší život, či už vás bude udržiavať bezpečnejšie, zdravšie alebo zlepšovať vašu pohodu. Uprostred súčasnej krízy v oblasti verejného zdravia a hospodárskej krízy, keď sa svet dramaticky mení a my sa všetci učíme a prispôsobujeme sa zmenám v každodennom živote, ľudia potrebujú wikiHow viac ako kedykoľvek predtým. Vaša podpora pomáha wikiHow vytvárať podrobnejšie ilustrované články a videá a zdieľať našu dôveryhodnú značku inštruktážneho obsahu s miliónmi ľudí po celom svete. Zvážte, prosím, prispieť na wikiHow ešte dnes.


