Obsah
Ostatné oddielyV chémii, valenčné elektróny sú elektróny, ktoré sa nachádzajú v najvzdialenejšom elektrónovom obale prvku. Vedieť, ako nájsť počet valenčných elektrónov v konkrétnom atóme, je pre chemikov dôležitá zručnosť, pretože tieto informácie určujú druhy chemických väzieb, ktoré môže vytvárať, a teda aj reaktivitu prvku. Našťastie všetko, čo potrebujete na nájdenie valenčných elektrónov prvku, je štandardná periodická tabuľka prvkov.
Kroky
Časť 1 z 2: Nájdenie valenčných elektrónov s periodickou tabuľkou
Neprechodné kovy
Nájsť periodická sústava prvkov. Toto je farebne odlíšený stôl zložený z mnohých rôznych štvorcov, ktorý obsahuje zoznam všetkých chemických prvkov známych ľudstvu. Periodická tabuľka odhaľuje veľa informácií o prvkoch - niektoré z týchto informácií použijeme na určenie počtu valenčných elektrónov v atóme, ktorý skúmame. Spravidla ich nájdete v obálke učebníc chémie. Online je tu tiež k dispozícii vynikajúci interaktívny stôl.

Označte každý stĺpec na periodickej tabuľke prvkov od 1 do 18. Všeobecne na periodickej tabuľke budú mať všetky prvky v jednom vertikálnom stĺpci rovnaký počet valenčných elektrónov. Ak vaša periodická tabuľka ešte nemá očíslované jednotlivé stĺpce, uveďte každému číslo začínajúce sa číslom 1 pre krajný ľavý koniec a 18 pre krajný pravý kraj. Z vedeckého hľadiska sa tieto stĺpce nazývajú prvok „skupiny“.- Napríklad, ak by sme pracovali s periodickou tabuľkou, kde skupiny nie sú očíslované, napíšeme 1 nad vodík (H), 2 nad berýlium (Be) a tak ďalej, kým nebudeme písať 18 nad hélium (He) .

Nájdite svoj prvok na stole. Teraz vyhľadajte na stole prvok, pre ktorý chcete nájsť valenčné elektróny. Môžete to urobiť pomocou chemického symbolu (písmená v každom políčku), jeho atómového čísla (číslo v ľavom hornom rohu každého poľa) alebo ľubovoľnej z ďalších informácií, ktoré máte na stole k dispozícii.- Napríklad nájdime valenčné elektróny pre veľmi častý prvok: uhlík (C). Tento prvok má atómové číslo 6. Nachádza sa v hornej časti skupiny 14. V ďalšom kroku nájdeme jeho valenčné elektróny.
- V tejto podkapitole budeme ignorovať prechodné kovy, ktoré sú prvkami v obdĺžnikovom bloku vytvorenými skupinami 3 až 12. Tieto prvky sa trochu líšia od ostatných, takže kroky v tejto podkapitole vyhrajú “ na nich nepracujem. Ako sa s nimi vyrovná, nájdete v pododdiele nižšie.

Pomocou čísel skupín určte počet valenčných elektrónov. Skupinové číslo neprechodného kovu možno použiť na zistenie počtu valenčných elektrónov v atóme tohto prvku. The jedno miesto čísla skupiny je počet valenčných elektrónov v atóme týchto prvkov. Inými slovami:- Valenčný elektrón skupiny 1: 1
- Skupina 2: 2 valenčné elektróny
- Skupina 13: 3 valenčné elektróny
- Skupina 14: 4 valenčné elektróny
- Skupina 15: 5 valenčných elektrónov
- Skupina 16: 6 valenčných elektrónov
- Skupina 17: 7 valenčných elektrónov
- Skupina 18: 8 valenčných elektrónov (okrem hélia, ktoré má 2)
- V našom príklade, pretože uhlík je v skupine 14, môžeme povedať, že jeden atóm uhlíka má štyri valenčné elektróny.
Prechodné kovy
Nájdite prvok zo skupín 3 až 12. Ako bolo uvedené vyššie, prvky v skupinách 3 až 12 sa nazývajú „prechodné kovy“ a pokiaľ ide o valenčné elektróny, správajú sa inak ako ostatné prvky. V tejto časti vysvetlíme, ako do istej miery často nie je možné priradiť valenčné elektróny týmto atómom.
- Napríklad si vyberieme Tantalum (Ta), prvok 73. V nasledujúcich krokoch nájdeme jeho valenčné elektróny (alebo aspoň skús až.)
- Upozorňujeme, že medzi prechodné kovy patria lantanoidy a aktinidy (tiež nazývané „kovy vzácnych zemín“) - dva rady prvkov, ktoré sú zvyčajne umiestnené pod zvyškom tabuľky a ktoré začínajú lantánom a aktíniom. Všetky tieto prvky patria do skupina 3 periodickej tabuľky.
Pochopte, že prechodné kovy nemajú „tradičné“ valenčné elektróny. Pochopenie toho, prečo prechodné kovy skutočne „nepracujú“ ako zvyšok periodickej tabuľky, si vyžaduje malé vysvetlenie spôsobu, akým sa elektróny správajú v atómoch. Nižšie nájdete rýchly prehľad alebo tento krok preskočte, aby ste sa dostali priamo k odpovediam.
- Keď sa elektróny pridajú k atómu, sú roztriedené do rôznych „orbitálov“ - v podstate do rôznych oblastí okolo jadra, v ktorých sa elektróny zhromažďujú. Valenčné elektróny sú zvyčajne elektróny v najokrajovejšej škrupine - inými slovami, posledné pridané elektróny .
- Z dôvodov, ktoré sú trochu príliš zložité na to, aby sme ich tu vysvetlili, keď sa elektróny pridávajú k najvzdialenejším d plášť prechodného kovu (viac o tomto nižšie), prvé elektróny, ktoré vstupujú do plášťa, majú tendenciu správať sa ako normálne valenčné elektróny, ale potom už nie, a elektróny z iných orbitálnych vrstiev niekedy pôsobia namiesto nich ako valenčné elektróny. To znamená, že atóm môže mať viac počtov valenčných elektrónov v závislosti od toho, ako sa s ním manipuluje.
Určte počet valenčných elektrónov na základe počtu skupín. Skupinové číslo prvku, ktorý skúmate, vám opäť môže povedať jeho valenčné elektróny. Pre prechodné kovy však neexistuje vzor, ktorým by ste sa mohli riadiť - číslo skupiny bude zvyčajne zodpovedať rozsahu možných počtov valenčných elektrónov. Sú to:
- Skupina 3: 3 valenčné elektróny
- Skupina 4: 2 až 4 valenčné elektróny
- Skupina 5: 2 až 5 valenčných elektrónov
- Skupina 6: 2 až 6 valenčných elektrónov
- Skupina 7: 2 až 7 valenčných elektrónov
- Skupina 8: 2 alebo 3 valenčné elektróny
- Skupina 9: 2 alebo 3 valenčné elektróny
- Skupina 10: 2 alebo 3 valenčné elektróny
- Skupina 11: 1 alebo 2 valenčné elektróny
- Skupina 12: 2 valenčné elektróny
- V našom príklade, pretože tantal je v skupine 5, môžeme povedať, že má medzi dvoj a päťvalenčné elektróny, v závislosti od situácie.
Časť 2 z 2: Nájdenie valenčných elektrónov s konfiguráciou elektrónov
Naučte sa čítať elektrónovú konfiguráciu. Ďalším spôsobom, ako nájsť valenčné elektróny prvku, je takzvaná elektrónová konfigurácia. Môžu to byť na prvý pohľad komplikované, ale sú to len spôsoby, ako reprezentovať elektrónové orbitaly v atóme pomocou písmen a čísel, a sú jednoduché, keď viete, na čo sa pozeráte.
- Pozrime sa na príklad konfigurácie prvku sodík (Na):
- 1s2s2p3s
- Všimnite si, že táto elektrónová konfigurácia je iba opakujúcim sa reťazcom, ktorý vyzerá takto:
- (číslo) (písmeno) (číslo) (písmeno) ...
- ...a tak ďalej. The (číslo) (písmeno) chunk je názov elektrónovej obežnej dráhy a je počet elektrónov v tejto obežnej dráhe - to je všetko!
- Pre náš príklad by sme teda povedali, že sodík áno 2 elektróny na obežnej dráhe 1 s plus 2 elektróny na obežnej dráhe 2 s plus 6 elektrónov na obežnej dráhe 2p plus 1 elektrón na obežnej dráhe 3 s. To je celkom 11 elektrónov - sodík je prvok číslo 11, takže to má zmysel.
- Majte na pamäti, že každé subshell má určitú elektrónovú kapacitu. Ich elektrónové kapacity sú nasledujúce:
- s: kapacita elektrónov 2
- kapacita elektrónu p: 6
- d: kapacita elektrónov 10
- kapacita elektrónu f: 14
- Pozrime sa na príklad konfigurácie prvku sodík (Na):
Nájdite elektrónovú konfiguráciu prvku, ktorý skúmate. Keď poznáte konfiguráciu elektrónov prvku, nájdenie jeho počtu valenčných elektrónov je celkom jednoduché (samozrejme okrem prechodných kovov.) Ak dostanete konfiguráciu od začiatku, môžete prejsť na ďalší krok. Ak si ho musíte nájsť sami, prečítajte si nižšie:
- Preskúmajte úplnú konfiguráciu elektrónov pre oganesson (Og), prvok 118, ktorý je posledným prvkom v periodickej tabuľke. Má najviac elektrónov zo všetkých prvkov, takže jeho elektrónová konfigurácia demonštruje všetky možnosti, s ktorými sa môžete stretnúť v iných prvkoch:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Teraz, keď to máte, stačí nájsť konfiguráciu elektrónov iného atómu iba vyplnením tohto vzoru od začiatku, kým vám nedôjde elektrón. Je to jednoduchšie, ako to znie. Napríklad, ak chceme vytvoriť orbitálny diagram pre chlór (Cl), prvok 17, ktorý má 17 elektrónov, urobili by sme to takto:
- 1s2s2p3s3p
- Všimnite si, že počet elektrónov je spolu 17: 2 + 2 + 6 + 2 + 5 = 17. Musíte zmeniť iba číslo na konečnej obežnej dráhe - zvyšok je rovnaký, pretože obežnice pred poslednou sú úplne plné .
- Viac informácií o konfiguráciách elektrónov nájdete v tomto článku.
- Preskúmajte úplnú konfiguráciu elektrónov pre oganesson (Og), prvok 118, ktorý je posledným prvkom v periodickej tabuľke. Má najviac elektrónov zo všetkých prvkov, takže jeho elektrónová konfigurácia demonštruje všetky možnosti, s ktorými sa môžete stretnúť v iných prvkoch:
Priraďte elektróny k orbitálnym škrupinám pomocou oktetového pravidla. Keď sa elektróny pridajú k atómu, rozpadajú sa na rôzne orbitaly podľa vyššie uvedeného poradia - prvé dva idú na obežnú dráhu 1 s, ďalšie dva idú na obežnú dráhu 2 s, šesť ďalších potom na obežnú dráhu 2 p a tak ďalej. Keď máme do činenia s atómami mimo prechodných kovov, hovoríme, že tieto orbitaly tvoria okolo jadra „orbitálne škrupiny“, pričom každá nasledujúca škrupina je vzdialenejšia ako tie predtým. Okrem úplne prvého obalu, ktorý môže obsahovať iba dva elektróny, môže každý obal obsahovať osem elektrónov (okrem prípadov prechodných kovov.), Ktorý sa nazýva Oktetové pravidlo.
- Povedzme napríklad, že sa pozeráme na prvok Boron (B). Pretože jeho atómové číslo je päť, vieme, že má päť elektrónov a jeho elektrónová konfigurácia vyzerá takto: 1s2s2p. Pretože prvá orbitálna škrupina má iba dva elektróny, vieme, že bór má dve škrupiny: jednu s dvoma elektrónmi 1 s a jednu s tromi elektrónmi z orbitálov 2s a 2p.
- Ďalším príkladom je, že prvok ako chlór (1s2s2p3s3p) bude mať tri orbitálne škrupiny: jednu s dvoma elektrónmi 1 s, jednu s dvoma elektrónmi 2 s a šesť elektrónov 2p a jednu s dvoma elektrónmi 3 s a päť elektrónov 3 p.
Nájdite počet elektrónov v najvzdialenejšom obale. Teraz, keď poznáte elektrónové škrupiny svojho prvku, nájdenie valenčných elektrónov je ľahké: stačí použiť počet elektrónov v najvzdialenejšom obale. Ak je vonkajší obal plný (inými slovami, ak má osem elektrónov alebo pre prvý obal dva), je prvok inertný a nebude ľahko reagovať s ostatnými prvkami. Opäť však platí, že tieto pravidlá pre prechodné kovy celkom nedodržiavajú.
- Napríklad, ak pracujeme s bórom, pretože v druhom plášti sú tri elektróny, môžeme povedať, že bór má tri valenčné elektróny.
Použite riadky tabuľky ako skratky na orbitálnej škrupine. Vodorovné riadky periodickej tabuľky sa nazývajú prvok „bodky“. Počnúc vrchom tabuľky každé obdobie zodpovedá počtu elektrónové škrupiny atómy v období majú. Môžete to použiť ako skratku na určenie toho, koľko valenčných elektrónov má prvok - pri počítaní elektrónov stačí začať od ľavej strany jeho periódy. Znovu budete chcieť ignorovať prechodné kovy pomocou tejto metódy, ktorá zahŕňa skupiny 3 - 12.
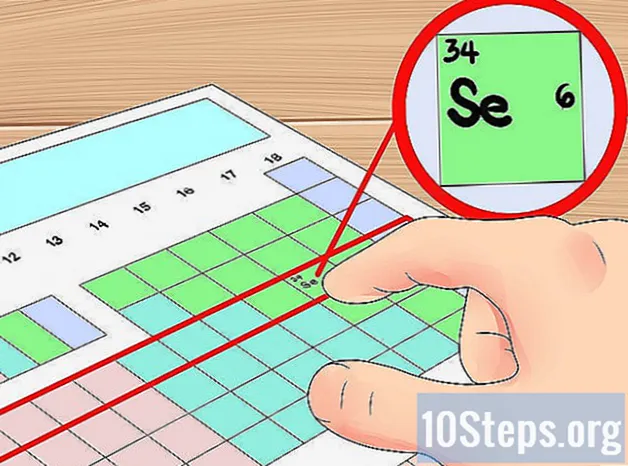
- Napríklad vieme, že prvok selén má štyri orbitálne mušle, pretože je vo štvrtej perióde. Pretože je to šiesty prvok zľava vo štvrtej perióde (ignorujeme prechodné kovy), vieme, že vonkajšia štvrtá škrupina má šesť elektrónov, a teda že selén má šesť valenčných elektrónov.
Otázky a odpovede pre komunitu
Ako vypočítame valenčný elektrón?
Valenčné elektróny možno nájsť určením elektronických konfigurácií prvkov. Potom počet elektrónov v najvzdialenejšom obale dáva celkový počet valenčných elektrónov v danom prvku.
Ak má atóm 33 elektrónov, koľko valenčných elektrónov je tam?
Ak atóm nie je ión, potom môžeme povedať, že má 33 protónov. To znamená, že ide o prvok 33, ktorý je arzén. Potom vieme, že nejde o prechodný kov, preto hľadáme a zisťujeme, že jednotková číslica jeho skupinového čísla je 5, čo znamená, že má 5 valenčných elektrónov.
Ako určím atómové číslo hélia?
Počet protónov sa rovná atómovému číslu.
Prečo elektróny získavajú záporný a nie kladný náboj?
Atómy získavajú alebo strácajú elektróny, záporné náboje, pretože protóny majú kladný náboj a v jadre ich drží silná jadrová sila. Toto je jedna zo štyroch odlišných síl vo vesmíre: gravitácia, elektromagnetizmus, slabá sila a silná jadrová sila. Musí to byť silné, pretože protóny sa navzájom odpudzujú, ale v jadre sú skutočne blízko seba (spolu s neutrónmi, ktoré tiež drží silná sila.) Myšlienka je, že silná sila je mimoriadne silná, ale iba na veľmi malé vzdialenosti. Pomysli na malé super silné háčiky. Ak chcete, aby sa protóny a neutróny spojili, potrebujete sily, ako je obrovská gravitácia hviezdy, supernova alebo jadrový výbuch.
Aký je záclonový elektrón vzácnych plynov?
Ušľachtilé plyny majú osem valenčných elektrónov - najstabilnejší stav pre prvok.
Prečo má dusík 6 zádržných elektrónov, ale je v skupine 15?
Dusík má iba päť záclonových elektrónov, pretože je v skupine 5, aj keď v skutočnosti v skupine 15 budete ignorovať prechodné kovy, pretože tieto skupiny majú iný spôsob stanovenia svojich valenčných elektrónov. Preto: skupina 13 znamená skupinu 3 atď.
Atóm má 7 protónov, 8 neurónov a 7 elektrónov. Aký je počet elektrónov v jeho valenčnej škrupine?
Prvok, ktorý obsahuje 7 protónov, je dusík. Dusík je v stĺpci prvkov, ktorý má vo valenčnej škrupine 5 elektrónov. Počet neutrónov je irelevantný pre zistenie počtu valenčných elektrónov v konkrétnom prvku.
Kde sa v periodickej tabuľke nachádzajú atómy so siedmimi elektrónmi vonkajšieho obalu?
Pozrite sa do druhého a posledného stĺpca na pravej strane vedľa inertných plynov.
Čo je to valenčný elektrón?
Valenčný elektrón je elektrón, ktorý sa nachádza na najvzdialenejšej časti atómu a môže byť zdieľaný alebo prijatý v reakcii.
Prečo majú prvky v periodickej tabuľke rôzny počet valenčných elektrónov?
Majú rôzne chemické štruktúry. Valenčné elektróny vytvárajú chemické reakcie.
Tipy
- Pamätajte, že elektrónové konfigurácie je možné písať akosi skratkou pomocou ušľachtilých plynov (prvky v skupine 18), ktoré zastupujú orbitaly na začiatku konfigurácie. Napríklad konfiguráciu elektrónov sodíka možno napísať 3s1 - je to v podstate to isté ako neón, ale s ďalším elektrónom v obežnej dráhe 3 s.
- Prechodné kovy môžu mať valenčné podškrupiny, ktoré nie sú úplne naplnené. Určenie presného počtu valenčných elektrónov v prechodných kovoch zahŕňa princípy kvantovej teórie, ktoré presahujú rámec tohto článku.
- Berte na vedomie, že periodické tabuľky sa v jednotlivých krajinách líšia. Skontrolujte prosím, či používate ten správny, aktualizovaný, aby ste predišli nedorozumeniam.
- Uistite sa, že viete, kedy sčítať alebo odčítať od poslednej obežnej dráhy na nájdenie valenčných elektrónov.
Veci, ktoré budete potrebovať
- Periodická tabuľka prvkov
- Ceruzka
- Papier
Každý deň sa na wikiHow tvrdo snažíme, aby sme vám poskytli prístup k pokynom a informáciám, ktoré vám pomôžu žiť lepší život, či už vás bude udržiavať bezpečnejšie, zdravšie alebo zlepšovať vašu pohodu. Uprostred súčasnej krízy v oblasti verejného zdravia a hospodárskej krízy, keď sa svet dramaticky mení a my sa všetci učíme a prispôsobujeme sa zmenám v každodennom živote, ľudia potrebujú wikiHow viac ako kedykoľvek predtým. Vaša podpora pomáha wikiHow vytvárať podrobnejšie ilustrované články a videá a zdieľať našu dôveryhodnú značku inštruktážneho obsahu s miliónmi ľudí po celom svete. Zvážte, prosím, prispieť na wikiHow ešte dnes.