Autor:
Mike Robinson
Dátum Stvorenia:
7 September 2021
Dátum Aktualizácie:
11 Smieť 2024
Obsah
Atómové číslo zodpovedá počtu protónov v jadre jedného atómu prvku. Táto hodnota sa nemení; preto ho môžete použiť na objavenie ďalších charakteristík izotopu, ako je počet neutrónov.
Kroky
Časť 1 z 2: Nájdenie atómového čísla
Nájdite kópiu periodickej tabuľky. Ak nemáte k dispozícii, kliknite sem. Každý prvok má svoje vlastné atómové číslo; neexistujú teda žiadne skratky na získanie obsahu. Použite kópiu tabuľky alebo sa ju pokúste zapamätať.
- Väčšina kníh o chémii má tabuľku vytlačenú na zadnom obale.

V tabuľke vyhľadajte prvok, ktorý študujete. Väčšina tabuliek obsahuje celý názov prvkov a ich symboly (napríklad Hg pre ortuť). Ak nenájdete, čo hľadáte, choďte online a vyhľadajte výrazy „chemický symbol“ a názov prvku.
Nájdite atómové číslo prvku. Zvyčajne je v ľavom alebo pravom hornom rohu domu elementu, môže však prichádzať aj na iné miesta. Okrem toho vždy ide o celočíselnú hodnotu.- Ak číslo obsahuje desatinnú čiarku, znamená to pravdepodobne atómovú hmotnosť.
Potvrďte informácie podľa prvkov v okolí. Periodická tabuľka je organizovaná podľa poradia atómových čísel. Ak je vaše číslo izotopu napríklad „33“, prvok vľavo bude „32“ a prvok vpravo bude „34“. V takom prípade je to preto, lebo sa pozeráte na atómové číslo.
- Medzi prvkami „56“ (bárium) a „88“ (rádio) je skok. Izotopy, ktoré zodpovedajú tomuto rozsahu, sú v dvoch riadkoch pod tabuľkou. Oddeľujú sa iba takto, aby stôl nebol príliš veľký.

Pochopte, čo znamená atómové číslo. Atómové číslo má jednoduchú definíciu: množstvo protónov v atóme prvku. Toto množstvo protónov zase určuje celkový elektrický náboj jadra - čo následne určuje, koľko elektrónov môže atóm nabiť. Pretože elektróny sú zodpovedné za takmer všetky chemické interakcie, atómové číslo nepriamo ovplyvňuje fyzikálne a chemické vlastnosti prvku.- Inými slovami, každý atóm s ôsmimi protónmi zodpovedá atómu kyslíka. Dva atómy kyslíka môžu mať rôzny počet neutrónov alebo (ak je jeden ión) alebo elektrónov, každý však bude mať vždy osem protónov.
Časť 2 z 2: Objavovanie dôležitejších informácií
Určte atómovú hmotnosť. Spravidla sa nachádza pod názvom prvku v periodickej tabuľke a má dve alebo tri desatinné miesta. Atómová hmotnosť zodpovedá priemernej hmotnosti atómov prvku, čo predstavuje jeho nález v prírode. Meria sa v „jednotkách atómovej hmotnosti“ („u“ alebo „u.m.a“).
- Mnoho vedcov dáva prednosť použitiu výrazu „atómová hmotnosť“ namiesto hmotnosti.
Pochopte atómovú hmotnosť. Pojem atómová hmotnosť je veľmi podobný pojmu hmotnosť. Rozdiel je v tom, že hmotnosť označuje priemernú hmotnosť ľubovoľného atómu v prvku, nie konkrétneho atómu. Napríklad: gram železa obsahuje niekoľko atómov s rôznou hmotnosťou; hmotnosť označuje ich „relatívnu hmotnosť“. Ak študujete jediný atóm prvku, musíte poznať jeho špecifickú hmotnosť.
- Problémy s chémiou týkajúce sa samotných atómov všeobecne už informujú o atómovej hmotnosti. Musíte pochopiť koncept, aby ste sa nenechali zaskočiť, keď uvidíte inú hodnotu.
Číslo hmotnosti zaokrúhlite. Hmotnostné číslo zodpovedá celkovému množstvu protónov a neutrónov v atóme prvku. Nie je ťažké to vypočítať: stačí vziať atómovú hmotnosť vytlačenú na periodickej tabuľke a zaokrúhliť ju na najbližšiu celú hodnotu.
- Funguje to preto, lebo množstvo neutrónov a protónov je veľmi blízke 1 u.m., zatiaľ čo množstvo elektrónov je veľmi blízke nule. Atómová hmotnosť zahŕňa presné výpočty na určenie desatinnej hodnoty, ale dôležité sú iba údaje, ktoré sú celé, a ktoré hovoria, koľko protónov a neutrónov existuje.
- Pamätajte, že ak použijete atómovú hmotnosť, budete narážať na váhu konkrétneho atómu v prvku. Napríklad vzorka brómu má atómovú hmotnosť 79 alebo 81.
Vypočítajte počet neutrónov. Teraz už viete, že atómové číslo sa rovná počtu protónov a že hmotnostné číslo sa rovná súčtu počtu protónov a neutrónov. Ak chcete určiť množstvo neutrónov v prvku, jednoducho odčítajte atómové číslo od tejto celkovej hmotnosti. Niekoľko príkladov:
- Atóm hélia (He) má hmotnostné číslo 4 a atómové číslo 2. Preto 4 - 2 = 2 neutróny.
- Vzorka striebra (Ag) má priemerné hmotnostné číslo 108 (podľa periodickej tabuľky) a atómové číslo 47. V priemere má každý atóm vo vzorke 108 - 47 = 61 neutrónov.
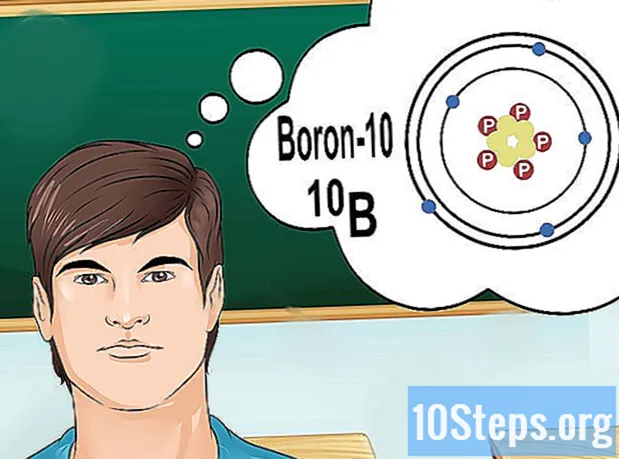
Pochopte izotopy. Izotop je špecifická forma prvku, ktorý obsahuje množstvo neutrónov. Ak problém, ktorý chcete vyriešiť, prináša niečo ako „bór-10“ alebo „B“, je to preto, že hovoríte o prvkoch bóru s hromadným číslom 10. Použite túto hodnotu, nie „normálne“ hodnoty bóru.
- Atómový počet izotopov sa nikdy nemení. Každý izotop prvku má rovnaký počet protónov.
Tipy
- Atómová hmotnosť niektorých ťažších prvkov je uvedená v zátvorkách alebo v hranatých zátvorkách. To znamená, že táto hmotnosť je presnou hmotou najstabilnejšieho izotopu, nie priemerom niekoľkých izotopov. Nakoniec to neovplyvní atómové číslo prvku.